
|
Science » » Przyszłość komórek macierzystych w medycynie [2] Innym poważną kwestią jest dostępność i możliwość namnożenia. ASC nie są tak łatwe w hodowli i relatywnie niewiele można ich uzyskać z pojedynczego źródła, zaś ESC z pojedynczego embrionu namnożone w komórkowym banku mogą wyprodukować tyle neuronów, ile jest potrzebne do terapii dziesięciu milionów pacjentów cierpiących na chorobę Parkinsona.[5] Terapia taka polega na wstrzykiwaniu komórek macierzystych w zniszczone przez chorobę rejony mózgu, regenerując tym samym tkankę. Pozyskanie dorosłych komórek macierzystych do takiego leczenia jest ekstremalnie problematyczne. Wielu naukowców jest zdania, że ASC są już zbyt wyspecjalizowane i dlatego, poza nielicznymi wyjątkami, nie nadają się do inżynierii tkankowej. Wstrzymajmy jednak na trochę nasz zachwyt nad ESC. Chciałbym bowiem przybliżyć Czytelnikowi jak wygląda sytuacja po drugiej stronie frontu. Nadzieja w dorosłych komórkach macierzystychJednym z celów rozwoju technologii ASC jest odpowiednie ich przeprogramowanie, tak aby „udawały" embrionalne komórki macierzyste. Innymi słowy, taka ich stymulacja, aby "cofnęły się w rozwoju" i odzyskały plastyczność. Przeprowadzono pewne badania, które sugerują, że w przypadku niektórych komórek jest to możliwe przez np. fuzję normalnych, dorosłych komórek z komórkami embrionalnymi.[6] Ponadto ASC wymagają znacznie poważniejszych modyfikacji, aby mogły stać się uniwersalnymi donorami [6] — należałoby je tak zmienić, aby pacjent otrzymujący transplant nie odrzucił go i nie musiał brać agresywnych leków immunosupresyjnych. Każda komórka ma na zewnątrz specyficzny znacznik, unikalny dla każdego organizmu, który jest przepustką pozwalającą spokojnie przejść przez kontrolę „strażników" naszego organizmu. Embrionalne komórki macierzyste są pod tym względem doskonalsze, zwłaszcza w przypadku leczenia centralnego układu nerwowego, do którego układ odpornościowy ma ograniczony dostęp. Wymiana znacznika w ASC będzie trudna technicznie, jednak uważa się, że możliwa.[6] Zajmijmy się teraz konkretnymi przypadkami, jakie zanotowano podczas badań nad dorosłymi komórkami macierzystymi. Na celowniku znalazły się głównie komórki szpiku kostnego, komórki macierzyste z centralnego układu nerwowego, skóry oraz mięśni. Udowodniono również istnienie komórek macierzystych w wątrobie i trzustce, ale są one słabiej poznane. Okazuje się, że jednym z kluczy do sukcesu może być nie ukierunkowywanie ich na pożywce, lecz mieszanie ich z tkanką docelową — wtedy otrzymują one sygnały do różnicowania się od sąsiadów. Wnioski takie wysuwane są bardzo ostrożnie, gdyż nie zawsze można jednoznacznie stwierdzić, czy komórka uległa konwersji, czy fuzji z sąsiadem, tworząc chimerę, o czym będę pisał nieco dalej. Od szpiku kostnego do mięśni, serca, wątroby i z powrotem, czyli co potrafią ASCSzpik kostny zawiera dwie główne populacje komórek macierzystych: mezenchymalną (początek dla tkanki łącznej, kostnej, śródbłonka, skóry, również mięśni gładkich) oraz krwiotwórczą część zrębu, która generuje wszystkie linie komórek krwi. Kilka projektów badawczych w ostatnich latach skupionych było na potencjale tworzenia przez nie komórek niebędących składnikami krwi. Jeden z nich udowodnił możliwość generacji komórek mięśniowych z komórek szpiku. Podczas badań mysz otrzymała transplant ze szpiku kostnego pochodzącego od innego osobnika oznakowanego specjalnym markerem genetycznym, dzięki którym można było śledzić losy komórek macierzystych. Stwierdzono obecność tego znacznika w komórkach mięśniowych po celowym ich uszkodzeniu — najwyraźniej komórki szpiku brały udział w regeneracji mięśni.[7] Inne doświadczenia wykazały dobroczynne działanie transplantu z komórek szpiku w leczeniu dystrofii mięśniowej u myszy. Co ciekawe, do eksperymentu użyto samczych komórek, a organizmem docelowym była samica. Znacznikami w tym przypadku były sondy wiążące się z chromosomem Y, które rozpoznały obecność samczego chromosomu w naprawionych tkankach mięśni szkieletowych i mięśni serca.[8] Jak wykazały inne eksperymenty, komórki szpiku, oprócz naprawy i połączenia się z komórkami mięśniowymi, są w stanie również zregenerować naczynia krwionośne w tkance sercowej.[9] Naukowcy już przeprowadzali próby kliniczne na pacjentach po ataku serca i zawale, którzy otrzymywali serie zastrzyków w uszkodzoną tkankę z ich własnych komórek macierzystych pobranych ze szpiku kostnego. Pacjenci podlegający tej terapii wykazywali znaczną poprawę, ich rekonwalescencja trwała krócej, a ich serca były kilkakrotnie bardziej wydajne w pompowaniu krwi.[10] Najwyraźniej opisywana technika za kilka lat stanie się standardem w leczeniu pacjentów po urazach serca. Pojawia się również coraz więcej sygnałów, że komórki szpiku kostnego potrafią również generować komórki wątrobowe w odpowiedzi na uszkodzenia, jak i również brać czynny udział w fizjologicznej wymianie komórek w tej tkance. Takie hepatocyty dostarczone przez komórki szpiku kostnego zaobserwowano podczas doświadczeń na myszach.[11] Co więcej, o takich procesach u ludzi przekonano się analizując komórki wątroby u pacjentek, które otrzymały przeszczep szpiku kostnego od mężczyzn. Można było u nich znaleźć hepatocyty z chromosomem Y. [12][13] Inna część szpiku - generacja komórek mezenchymalnych jest zdolna do tworzenia in vitro adipocytów, chondrocytów i osteocytów wchodzących w skład układu kostnego — komórki takie, przeszczepione dzieciom z wrodzoną łamliwością kości (osteogenesis imperfecta), wykazują pozytywne działanie i duży potencjał kliniczny.[14] Istnieją pewne dowody, że omawiane komórki mogą również generować nie tylko mezenchymalne tkanki — są również zdolne do wytwarzania astrocytów (komórek pomocniczych układu nerwowego) i najprawdopodobniej neuronów (komórek przekazujących sygnały nerwowe) po wstrzyknięciu do noworodkowej tkanki mózgowej.[15] Stosunkowo niedawno dwa zespoły odkryły niezależnie oznakowane neurony w mózgach myszy, które uprzednio otrzymały przeszczep szpiku kostnego [16][17], co zwróciło uwagę naukowców na tę część komórek szpiku. Dokładniejsza analiza oczyszczonych mezenchymalnych komórek macierzystych ukazała pewne dodatkowe komórki, które znajdowały się w tej samej frakcji. Nazwano je mulitpotencjalnymi dorosłymi prekursorami komórkowycmi, w skrócie MAPC (Multipotent Adult Progenitor Cells), ze względu na ich zadziwiające właściwości. Oprócz komórek mezenchymalnych, potrafią in vitro zróżnicować się również w komórki mezodermalne, neuroektodermę i endodermę. Co więcej wstrzyknięte do blastocysty, pojedyncze MAPC wchodzą w skład praktycznie wszystkich typów komórek naszego ciała.[18] Wstrzyknięte do niepodrażnionego organizmu wędrują po całym ustroju i zaszczepiają się w tkankach różnicując się w krwiotwórczą część szpiku, nabłonek wątroby, płuc czy narządów układu pokarmowego. Stopień kontrybucji w tkanki zwiększa się znacznie, gdy zostaną wstrzyknięte do podrażnionego (napromieniowanego) ustroju.[18] Wydaje się, że odnalezienie MAPC jest dotychczas największym sukcesem w poszukiwaniu komórek do przeszczepu i przyszłościowej transplantologii. Mają duży potencjał i nie przekształcają się w nowotwory, są relatywnie łatwe do hodowli i mogą być pozyskane od samego pacjenta. Dalsze badania powinny udoskonalić techniki ich pozyskiwania, namnożenia i manipulowania ich właściwościami. Zamienić umysł w ciałoPrzez długi czas uważano, że neurogeneza u ssaków była ograniczona do okresu embrionalnego oraz krótkiego czasu po porodzie. Dzisiaj jednak wiemy, że neurony są nieprzerwanie wymieniane lub dodawane w niektórych regionach mózgu dorosłych ssaków, w tym człowieka. Neurony te są dostarczane przez samoodnawialne, multipotencjalne nerwowe komórki macierzyste, które dają również początek astrocytom i oligodendrocytom. Wyszczególniono dwie główne populacje nerwowych komórek macierzystych: komórki ependymalne oraz astrocyty strefy podkomorowej.[19] Do końca nie wiadomo, czy obie populacje dzielą wspólną początkową linię, czy też są niezależne. Potencjał nerwowych komórek macierzystych udowodniono śledząc ich losy prowadzące do wykształcenia komórek krwiotwórczej części zrębu. Nerwowe komórki dostarczone z dorosłych myszy były utrzymywane w hodowli jako specyficzne neurosfery - agregaty komórek swobodnie pływające w pożywce. Mogły być w ten sposób efektywnie namnożone. Taką mieszaninę komórek wstrzyknięto myszy, która uprzednio została napromieniowana z prawie śmiertelnym skutkiem. Dostarczone komórki były w stanie zregenerować szpik kostny i doprowadzić do wznowienia produkcji krwinek.[20] Ta sama grupa naukowców przeprowadziła doświadczenie polegające na wstrzyknięciu nerwowych komórek macierzystych do mięśni szkieletowych, co doprowadziło do przekształcenia ich w funkcjonalne komórki mięśniowe. Proces ten zaszedł dzięki sygnałom wysyłanym z sąsiadujących komórek. Co ciekawsze, różnicowanie nerwowych komórek macierzystych w mięśniowe zachodzi nawet spontanicznie w kulturach komórkowych o niskiej gęstości.[21] 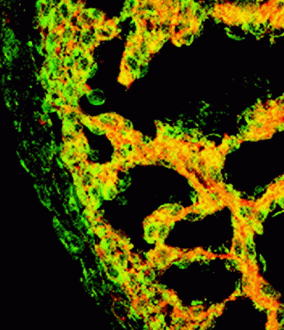 Rycina 3. ASC budują tkankę serca. Macierzyste komórki biorące udział w budowie świecą na zielono, na czerwono świeci znacznik charakterystyczny dla mięśni. Żółty kolor to efekt nakładania się barw. [22] [ 1 ] Jonas Frisen, specjalista w dziedzinie ASC z Karolinska Instituet w Sztokholmie, wraz ze współpracownikami prześledził losy neuronalnych komórek macierzystych umieszczonych w tworach embroidalnych — wystawionych na wiele sygnałów międzykomórkowych i potwierdził również różnicowanie w komórki mięśniowe serca (Ryc. 3) oraz komórki mięśni szkieletowych. (Ryc. 4) [22] 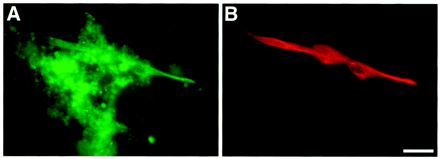 Rycina 4. Różnicowanie nerwowych komórek macierzystych w mięśniowe. Panel A przedstawia specyficzny dla neuronów zielono fluoryzujący barwnik. Po zmianie długości światła fotografia przedstawia czerwone wybarwienie charakterystycznego markera komórek mięśniowych. [22] [ 1 ]
Footnotes: [ 1 ] Przedrukowane i zmodyfikowane za zgodą autora oraz
wydawcy z „Generalized Potential of Adult Neural Stem Cells", by Diana
Clarke and Jonas Frisen, Science
2000, Vol 288: 1660-63, Copyright ©
2000 AAAS (Ref # 04-0977w). UWAGA: Czytelnicy mogą przeglądać oraz pobierać powyższy materiał tylko do celu prywatnego, niekomercyjnego użytku. Powyższy materiał jest chroniony przez prawo autorskie, nie może być reprodukowany, rozpowszechniany, modyfikowany, adaptowany, przedstawiany albo sprzedawany w całości lub częściach bez uprzedniego zezwolenia wydawcy. « (Published: 12-06-2004 Last change: 19-06-2004)
page 3443 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [ Cooperation ] [ Advertise ] [ Map of the site ] [ F.A.Q. ] [ Store ] [ Sign up ] [ Contact ] The Rationalist © Copyright 2000-2018 (English section of Polish Racjonalista.pl) | ||



 Ukończył biologię molekularną na Uniwersytecie Adama Mickiewicza w Poznaniu. Pracował jako Research Specialist in Health Science w Department of Anatomy and Cell Biology na University of Illinois w Chicago. Obecnie pracuje jako Associate Cell Biologist / Histologist w Abbott Laboratories (Illinois). Specjalizuje się w ekspresji białek 'od zera', hodowlach linii komórkowych, symulacji in vitro procesów zachodzących w komórkach. Jego pasją jest teoria ewolucji, w szczególności ewolucja systemów biochemicznych i pochodzenie życia we Wszechświecie.
Ukończył biologię molekularną na Uniwersytecie Adama Mickiewicza w Poznaniu. Pracował jako Research Specialist in Health Science w Department of Anatomy and Cell Biology na University of Illinois w Chicago. Obecnie pracuje jako Associate Cell Biologist / Histologist w Abbott Laboratories (Illinois). Specjalizuje się w ekspresji białek 'od zera', hodowlach linii komórkowych, symulacji in vitro procesów zachodzących w komórkach. Jego pasją jest teoria ewolucji, w szczególności ewolucja systemów biochemicznych i pochodzenie życia we Wszechświecie.