
|
Science » » Priony. Czyżby nowożytny miecz Damoklesa? [2] Więcej wiadomo o modyfikacjach posttranslacyjnych prionów. Do białka PrP przyłączane zostają części cukrowe oraz lipidowe (dzięki nim zakotwicza się w błonie komórkowej od strony cytoplazmy). W komórkach może również wystąpić druga izoforma prionu (alternatywna struktura przestrzenna), jest ona jednak infekcyjna („scrapie") — ozn. PrPSc (zamienne symbole: PrPres, PrPd, Sc). Izoforma ta jest przyczyną chorób pionowych. Wcześniej uważano, że różne formy przestrzenne białka prionowego są wynikiem alternatywnego składania eksonów — zjawiska spotykanego często, szczególnie u ssaków. [ 13 ] Okazało się, że sekwencje aminokwasów obu form białka PrP są identyczne. Było to pierwsze białko, dla którego zaobserwowano takie zjawisko. Jest to zarazem jedna z najważniejszych cech prionów. Wspomniana forma infekcyjna („scrapie") charakteryzuje się obecnością rozbudowanej, w porównaniu do struktury PrPc, β-kartką oraz odznacza się mniejszą zawartością α-helisków. Nie są to jedyne różnice. Struktury te cechuje także różna rozpuszczalność w wodzie i podatność na trawienie enzymami proteolitycznymi (tzw. proteazy; dokonują hydrolizy wiązań peptydowych). Forma PrPSc wytrąca się w środowisku wodnym i jest odporna na proteolizę. Ma to poważne konsekwencje w patogenezie chorób prionowych. Tabela [ 14 ]
Istnieje cała grupa chorób układu nerwowego, w których czynnikiem sprawczym są tzw. patologiczne konformery (białka o nieprawidłowej konformacji); nieoficjalnie używa się niekiedy przenośni „nowotwory białek". Białka mające właściwość zmiany kształtu innych białek nazywane są chaperonowymi. Prion nie jest więc wyjątkiem, jego specyfiką jest fakt, iż zmieniając swą konformację staje się zakaźny! Rozwiązanie struktury PrP nastąpiło głównie dzięki technice spektroskopii rezonansu magnetycznego. Natomiast w przypadku formy patogennej nie możemy uzyskać jej roztworu, ani kryształu przez co spektroskopia, krystalografia stają się bezużyteczne; dowodów pośrednich dostarczają inne metody, np. diploizmu kołowego. Cząstka prionu składa się z około tysiąca monomerów, jeśli rzeczywiście zawiera jakiś odcinek kwasu nukleinowego to ma długość on nie więcej niż 200 nukleotydów. [ 15 ] Aby w pełni zrozumieć istotę prionów przybliżę wpierw strukturę białek. Struktura białka: - I-rzędowa — in. pierwotna; łańcuch polipeptydowy zsyntetyzowany przez rybosom w procesie translacji (biosyntezy); sekwencja aminokwasów w łańcuchu białkowym. Struktura ta zapisana jest w genie kodującym układ aminokwasów danego białka, a utrzymują ją kowalencyjne wiązania peptydowe [ 16 ];  [ 17 ] [ 17 ]Rybosom — organellum w którym powstają białka 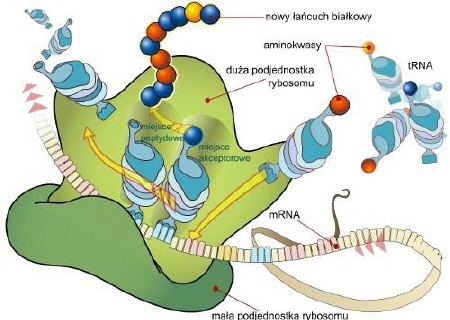 Mechanizm działania rybosomu (schemat ukazuje translację mRNA; fazę elongacji) [ 18 ] - II-rzędowa — ułożenie poszczególnych fragmentów w przestrzeni, utrzymywana przez wiązania wodorowe między aminokwasami. Najbardziej stabilne układy przestrzenne (tzw. układy regularne) to alfa helisa (a-helisa) i kartka beta (struktura b, zwana też harmonijkową).
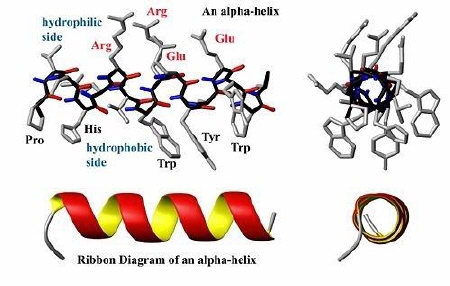 Struktura a-helisa [ 20 ] 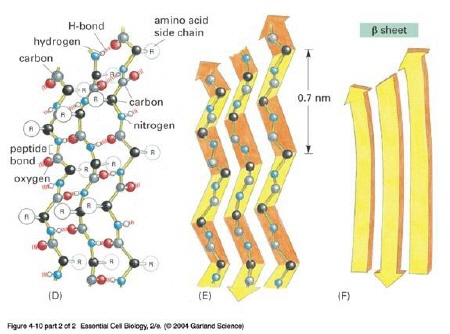 Struktura kartka b [ 21 ] - III-rzędowa — in. konformacja — przestrzenne pofałdowanie łańcucha struktury a-helisu wynikające z oddziaływań między resztami R niektórych aminokwasów (konkretnie mogą to być wiązania jonowe, oddziaływania hydrofobowe, mosteczki dwusiarczkowe powstające między parą cystein w tej samej cząstce białka Cys-Cys, czy oddziaływania van der Waalsa). [ 22 ] - IV-rzędowa — dotyczy tylko białek budowanych przez kilka dużych podjednostek (np. hemoglobina), łańcuchy polipeptydowe łączą się w jedną, funkcjonalną całość (in. łańcuchy o strukturze III-rzędowej tworzą układ przestrzenny). 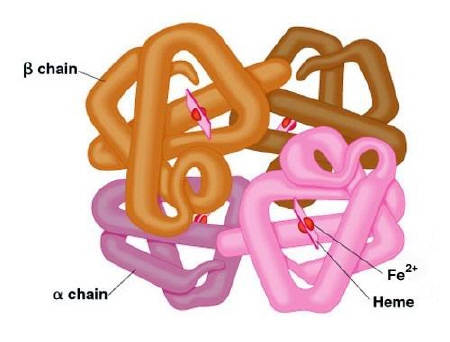 [ 23 ] [ 23 ]Struktura hemoglobiny Przyjmuje się, że prion nabiera cech patogennych w wyniku nagłej zmiany struktury trzeciorzędowej (łańcuch polipeptydowy); przy czym nie dotyczy to sekwencji aminokwasowej, przeobrażeniu ulega przestrzenna forma cząsteczki, stając się tzw. PrPSc -prionem powodującym scrapie(in. skarpie), chorobę występującą u kóz i owiec. 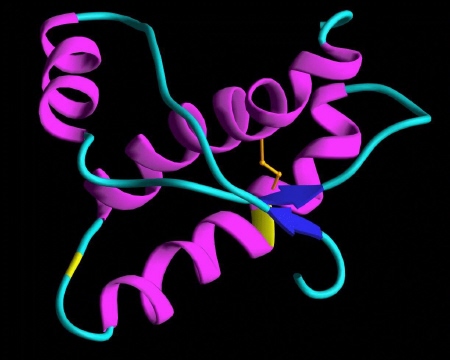 Konformacja białka PrP [ 24 ] Konwersja PrPc do PrPSc następuje po ponownym wejściu cząsteczki do komórki poprzez jamkowe domeny lub wyłożone latryną zagłębienia. Tak więc prion może być izoformą normalnego białka lub produktem zmutowanego genu, aczkolwiek mechanizm powstawania formy PrPSc wymaga jeszcze wielu badań. Tak naprawdę wciąż nie wiemy jak to się odbywa. Zaproponowano model tłumaczący to zjawisko. [ 25 ] Otóż białko PrP przyjmuje dwie formy przestrzenne, których zmiana jest procesem spontanicznym. Forma PrPc nie posiada zdolności tworzenia „polimerów" w przeciwieństwie do formy infekcyjnej, która przy udziale β-kartki może przyłączać kolejne cząsteczki tego białka. Proces ten jednak jest całkowicie odwracalny do momentu osiągnięcia przez polimeryzujące molekuły PrPSc rozmiaru krytycznego. Osiągnięcie takiego rozmiaru oznacza, że polimer cząsteczek PrPSc nie może już się zmniejszyć, nie ma wówczas możliwości powrotu do konformacji PrPc. W ten sposób powstają tzw. złogi β-amyloidowe (beta-amyloidowe), stanowiące według wielu badaczy przyczynę m.in. choroby Creutzfeldta-Jakoba (CJD). [ 26 ] Złogi te niekiedy pękają i są przekazywane do komórek potomnych przy podziale komórkowym. [ 27 ] Tak więc reasumując, mechanizm szkodliwości prionów zakaźnych (neurotoksyczność) polega na gromadzeniu się ich w komórkach, w błonach wakuol, zaburzeniu recyrkulacji błon oraz akumulowaniu zewnątrzkomórkowo w postaci tzw. beta-amyloidu. Przypuszczalnie przyczyniają się do indukcji apoptozy neuronów, powodują zaburzenia glikozylacji i metabolizmu PrP. Naukowcy stwierdzili że priony są białkami, które wnikając do komórki indukują syntezę potranskrypcyjnych czynników modyfikujących, w wyniku czego pojawia się zmodyfikowane białko. Możliwy schemat przemian:
1.
Białko PrP o konformacji prawidłowej (globularnej).
Footnotes: [ 13 ] Ekson
(egzon, sekwencja kodująca) — w komórkach eukariotycznych odcinek genu kodujący
sekwencję aminokwasów w cząsteczce białka. [ 14 ] Na
podstawie: T. Ishikawa „Priony — u ssaków i drożdży"
[w:]
http://www.olimpbiol.uw.edu.pl/UserFiles/File/wyklady/priony.pdf [ 15 ] Jeśli
czynnik scrapie zawiera genom kwasu nukleinowego, to musi on być tysiąc
razy mniejszy od genomu najmniejszego znanego wirusa (R. Rhodes, 2000 r.). [ 16 ] W istocie biosynteza odbywa się zwykle w tzw. polisomach (polirybosomy, informosomy), strukturach odkrytych w roku
1963. Polisom utworzony jest przez zespół rybosomów związanych z jedną
cząsteczką mRNA i prowadzących jej translację, czyli syntezę białek. Polisomy
mogą występować w postaci pojedynczych ziarenek w cytoplazmie, bądź systemu
rybosomów przyczepionych do błon siateczki śródplazmatycznej szorstkiej (ER-g).
Umożliwiają efektywniejsze wykorzystanie matrycy mRNA w czasie — jednocześnie na
jednej nici mRNA wiele pojedynczych rybosomów syntetyzuje wiele łańcuchów
peptydowych, zanim zostanie rozłożona. System ten jest szczególnie wydajny u
Eukaryota.
Pierwszymi
białkami, których skład i sekwencję aminokwasów poznano, była insulina (51
aminokwasów)i rybonukleaza (124).
[ 18 ] źródło:
http://pl.wikipedia.org/wiki/ [ 19 ] Występuje
zarazem w białkach o dużej wytrzymałości mechanicznej, np. w keratynie
(włosy, naskórek), miozynie (mięśnie). [ 21 ] ibidem [ 22 ] denaturacja — zniszczenie struktury III-rzędowej, np. w wyniku wysokich temperatur,
obecności mocznika, znacznych zmian pH, detergentów, jonów metali ciężkich. [ 25 ] Hipotezy konwersji i propagacji PrP: 1. model polimeryzacji — zakłada tworzenie się ziaren — ośrodków agregacji powodujących zmianę konformacji kolejnych cząstek PrPc hipoteza szablon-pomocnik (template-assistance) /hipoteza heterodimerów — PrPc wiąże się z PrPSc lub nieprawidłowo sfałdowanym białkiem prionowym (heterodimer), po czym ulega przekształceniu do PrPSc - powstaje homodimer, który rozłącza się, aby utworzyć kolejne heterodimery. [ 26 ] in.
Kreutzfeldta Jakoba [ 27 ] Prawdopodobny
mechanizm powodujący formowanie złogów przez białka prionowe (trafiają do
cytozolu zamiast do błony komórkowej) przedstawiony jest w T. Ishikawa, op.
cit., s.6-7. « (Published: 24-02-2011 Last change: 25-02-2011)
page 951 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [ Cooperation ] [ Advertise ] [ Map of the site ] [ F.A.Q. ] [ Store ] [ Sign up ] [ Contact ] The Rationalist © Copyright 2000-2018 (English section of Polish Racjonalista.pl) | ||



 Nauczyciel, publikował w piśmie "Gameranking", współpracuje z miesięcznikiem "21. Wiek" (członek zespołu redakcyjnego). Autor książki "Cywilizacja traw". Pióro do wynajęcia.
Nauczyciel, publikował w piśmie "Gameranking", współpracuje z miesięcznikiem "21. Wiek" (członek zespołu redakcyjnego). Autor książki "Cywilizacja traw". Pióro do wynajęcia.